- · 《海外文摘·学术版》栏目[05/29]
- · 《海外文摘·学术版》刊物[05/29]
- · 《海外文摘·学术版》征稿[05/29]
- · 《海外文摘·学术版》投稿[05/29]
- · 《海外文摘·学术版》收稿[05/29]
周末文摘 | IMDRF 新版“医疗器械安全有效基本
作者:网站采编关键词:
摘要:引用本文: 李非,姜琳琳,袁鹏,张世庆*.IMDRF 新版“医疗器械安全有效基本要求”介绍及应用研究[J].中国食品药品监管.2020.04(195):94-101. 摘 要 摘 要 医疗器械;安全有效基本要求

引用本文:
李非,姜琳琳,袁鹏,张世庆*.IMDRF 新版“医疗器械安全有效基本要求”介绍及应用研究[J].中国食品药品监管.2020.04(195):94-101.
摘 要
摘 要
医疗器械;安全有效基本要求;IMDRF ;注册审评;科学监管

IMDRF 设置良好监管评价实践(Good Regulatory Review Practice) 工作组,提出以“医疗器械安全和性能基本原则”为核心,以“符合性评价原则”为监管评价方法,以“注册申报资料”为政府与企业之间的媒介,形成了三位一体的医疗器械上市前审查体系[3],其宗旨是供监管机构(RA)、合规性评估机构(CAB)、行业和其他利益相关方使用,并将以一致的方式为建立有利于公众健康的医疗器械监管,提供经济有效的方法,以达到科学审评并鼓励和支持监管体系全球协调的最终目的[4]。
我国积极参与IMDRF 事务,2018 年作为IMDRF 轮值国,发布了《医疗器械临床评价》等重要文件,积极推动IMDRF文件落地实施。在EP 方面,国家药品监督管理局迅速推动落地转化工作,仅一年时间就发布了征求意见稿,为在中国进一步推进国际领先的良好监管评价实践做出巨大努力。因此,研究解读新EP 的主要内容,对我国医疗器械审评审批体制改革,推进审评的科学性和系统性具有重要意义。

《医疗器械注册管理办法》对注册的定义为:医疗器械注册是食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程[5]。这也是医疗器械审评科学要解决的核心问题,即系统评价医疗器械安全性和有效性。将复杂问题简单化是一种科学方法,将“系统评价医疗器械安全性和有效性”的问题进行分解,可以分解成为以下三个子问题:什么是安全性和有效性?如何系统评价?评价原则是什么?
① 2005 年首次发布了医疗器械安全有效基本原则(2018 年第3 次修订),为所有医疗器械定义了通用安全有效基本要求,说明了什么是医疗器械的安全有效[6]。
② 2006 年发布医疗器械符合性评价原则(2012 年修订),说明了如何评价医疗器械的安全有效[7]。
③ 2008 年发布了符合医疗器械安全有效基本原则的技术文件汇总(STED),说明了证明医疗器械的安全有效性需要提供哪些证据,其中包括了医疗器械安全有效基本要求清单(以下简称清单),该清单是STED 的核心文件[8]。
我国在2014 年《医疗器械注册管理办法》法规修订时,吸纳了国际先进的监管经验,将安全有效的理念融入医疗器械的设计和生产中,并写入《医疗器械注册管理办法》第十一条,“申请人或者备案人申请注册或者办理备案,应当遵循医疗器械安全有效基本要求,保证研制过程规范,所有数据真实、完整和可溯源”[5],同时将医疗器械安全有效基本要求纳入注册申报资料要求中。医疗器械安全有效基本要求是以医疗器械作为对象,对其在整个生命周期内必须达到的安全和性能要求作出明确的规定。任何人向社会推出的医疗器械产品都必须符合这个基本要求。
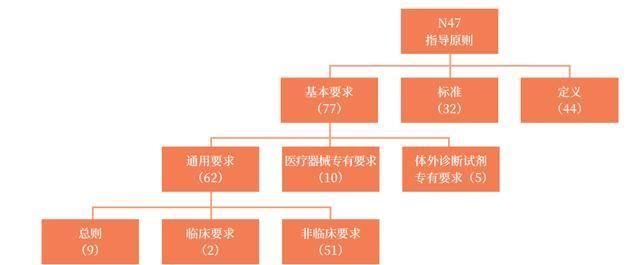
2.1 层级结构
2018 年10 月IMDRF 发布的《医疗器械和体外诊断器械安全有效基本要求》(以下简称“N47 指导原则”)主要内容分三个层级。第一级是基本要求及其相关的标准和定义,其中基本要求77 条、标准32 条、定义44 个。第二级按照医疗器械类别分为三个部分:适用于全部医疗器械的通用要求62 条,适用于医疗器械的专用要求10 条,适用于体外诊断试剂的专用要求5 条。第三级将通用要求分成总则、临床要求和非临床要求三个部分,如图1 所示。
2.2 通用要求
通用要求是适用于所有医疗器械的要求,按照内容分为三个部分:总则、临床要求和非临床要求。总则从医疗器械全生命周期的角度提出安全和有效的原则,并给出评价标准;临床要求从临床证据的角度提出要求;非临床要求从化学、物理和生物学特性、灭菌和微生物控制、对电气、机械和热风险的防护等11 个方面提出要求。
总则共9 条,其中5.1.2 风险管理系统、5.1.3 风险控制措施、5.1.4 剩余风险告知和5.1.5 风险降低与消除是与安全有关的原则;5.1.1 预期性能、5.1.6 性能退化、5.1.7 包装运输贮存和5.1.8 稳定性是与有效有关的原则;5.1.9 是安全有效的评价标准,即所有风险以及非预期影响应最小化并可接受,保证医疗器械在正常使用中受益大于风险,总则各项要求见图2。
文章来源:《海外文摘·学术版》 网址: http://www.hwwzzz.cn/zonghexinwen/2020/0713/358.html
上一篇:文艺在线·夜听|诗朗诵:黄梅戏
下一篇:指尖 | 且看飞鸟川